医療機器安全性試験用対照材料
食品薬品安全センターでは、「医療機器の製造販売承認申請等に必要な生物学的安全性評価の基本的考え方について」(薬生機審発0106第1号)および国際規格であるISO 10993シリーズにおける下記試験に記載されている対照材料を頒布しております。
- 細胞毒性試験用(陽性/陰性対照)
- 短期筋肉内埋植試験用(陽性/陰性対照)
- 骨埋植試験用(陰性対照)
- 溶血性試験用(陽性対照)
- インビトロ皮膚刺激性試験用(陽性対照)
お申し込み
「対照材料注文書」をご記入の上、対照材料担当宛に電子メールでお申し込みください。
お問い合わせは、「お問い合わせフォーム」または TEL : 0463-85-2525 (内線523) にて、ご連絡ください。
お知らせ
2025年3月3日
EOG滅菌注文の発送遅延につきまして
対照材料で使用しているEOG滅菌器が更新時期を迎えたことに伴い、現在更新計画を立てております。
更新期間中は当財団所有の他の機器を代替機として使用する予定です。
なお、当該期間中は代替機の使用状況が過密になり、発送までに通常より時間を要する可能性がございます。
EOG滅菌をご利用の皆様にはご不便ご迷惑をおかけいたしますが、ご理解ご協力賜りますようお願い申し上げます。
更新予定時期:2025年3月から4月末
(バリデーションの進捗状況により、更新完了時期が変更される可能性がございます。)
更新期間中の対応:当財団所有の他の機器を代替機として使用、滅菌いたします。
リードタイム(発送日):ご注文時、当財団からの受領メールにて個別に連絡いたします。
2025年3月3日
年度末請求書発行日につきまして
年度末の請求書発行時期は以下の通りとなります。
【2024年度】2025年3月26日 午前中までのご注文(EOG滅菌を含まない)
→2024年3月31日付の請求書を発行いたします。
【2025年度】上記以降のご注文は2025年4月以降の請求書発行となります。
EOG滅菌処理で2024年度の請求書発行をご希望の場合は3月初旬までにご注文いただきますようお願いいたします。
2020年1月6日
溶血性試験およびインビトロ皮膚刺激性試験に用いる対照材料頒布開始のお知らせ
「医療機器の生物学的安全性評価の基本的考え方」(改定案)において、現在頒布しております医療機器の生物学的安全性試験(細胞毒性試験および埋植試験)に用いる対照材料に加え、下記の対照材料が新たに記載されました。
新規のYシリーズにつきましては、頒布開始が遅れ、ご迷惑をお掛け致しましたが、この度、2020年1月6日よりお申込みの受付を開始できる運びとなりました。試験の目的にあった製品を選択のうえ、ご利用のほど宜しくお願い致します。
なお、購入時に添付します対照材料情報シートへは、溶血性試験およびインビトロ皮膚刺激性試験ともに細胞傷害性を指標として評価する試験であることから、Yシリーズも含めこれまで同様、V79細胞を用いる細胞毒性試験の試験結果(コロニー形成法によるIC50値)の記載とさせていただきますので、ご承知おきください。
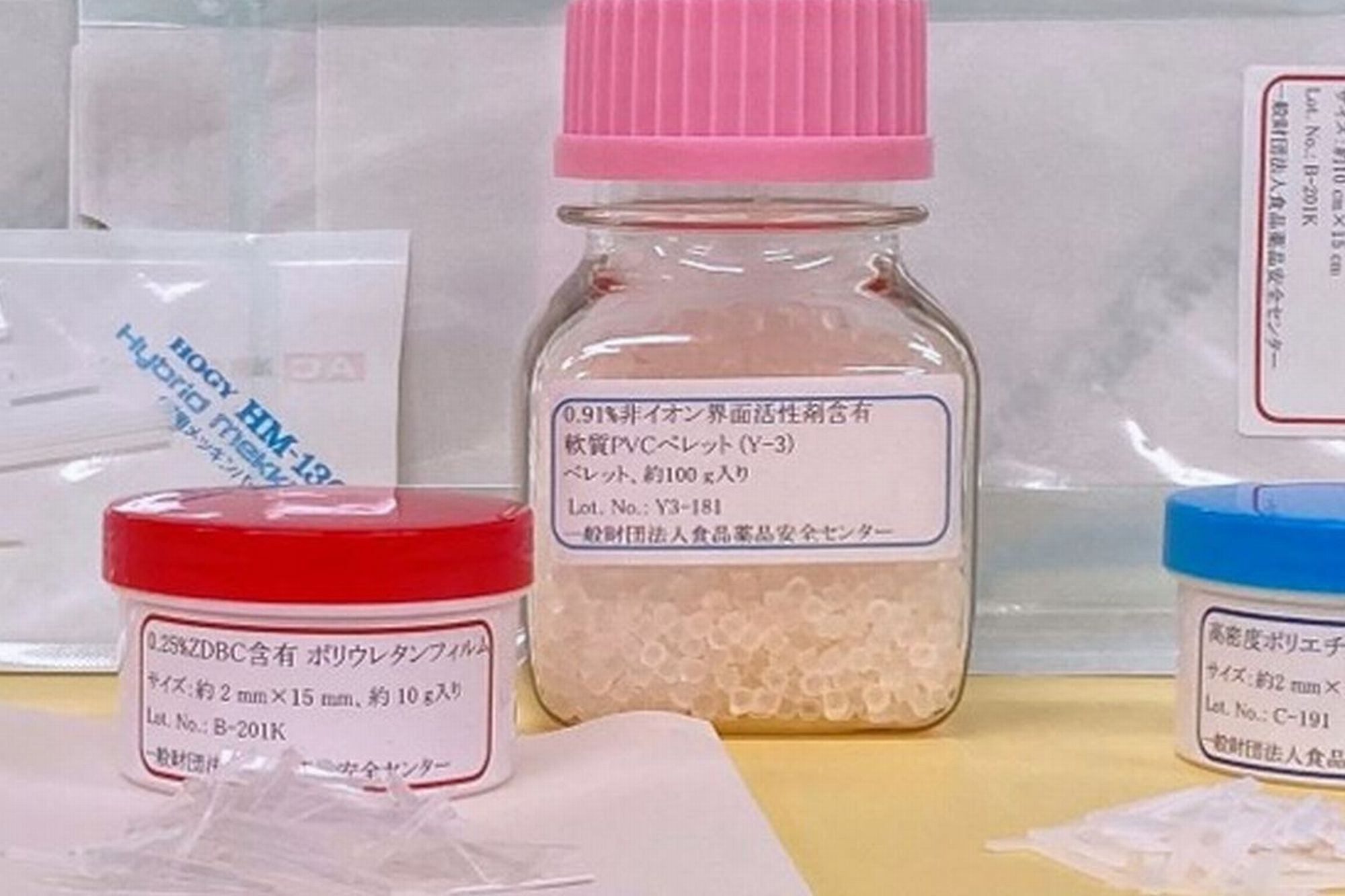
- 溶血性試験用陽性対照材料
- ・0.91%非イオン界面活性剤含有軟質ポリ塩化ビニルペレット(Y-3)
- [Plasticized polyvinyl chloride pellet containing 0.91% non-ionic surfactant (Y-3)]
- インビトロ皮膚刺激性試験用陽性対照材料
- ・5.8%非イオン界面活性剤含有軟質ポリ塩化ビニルペレット(Y-4)
- [Plasticized polyvinyl chloride pellet containing 5.8% non-ionic surfactant (Y-4)]
ポリ塩化ビニル(PVC)を主成分とする上記製品の添加剤は以下の通りです。
| 製品 | Genapol X-080 |
DEHP | ESBO | Calcium stearate | Zinc stearate |
|---|---|---|---|---|---|
| Y-3 | 0.91 | 33.4 | 4.9 | 0.030 | 0.030 |
| Y-4 | 5.8 | 31.8 | 4.6 | 0.029 | 0.029 |
Yシリーズの開発経緯・関連論文
本品(Yシリーズ)は、溶血性試験における弱陽性材料(Y-2)、中陽性材料(Y-3)および強陽性材料(Y-4)として国立医薬品食品衛生研究所で開発され、異なる試験条件下でその反応性が確認されています(1、2参照)。
Y-2およびY-3は、ISO 10993 Part 4:Selection of tests for interactions with bloodのワーキンググループ(WG9)が実施したラウンドロビンテストにも使用されました。
また、Y-4については、再構築ヒト培養皮膚(RhE)モデルによるin vitro 皮膚刺激性試験およびウサギを用いる皮内反応試験で陽性反応が確認されるとともに、ISO 10993 Part 10:Tests for irritation and delayed-type hypersensitivityのワーキンググループ(WG8)が実施したRhEモデルによるラウンドロビンテストにも使用されました(3~5参照)。
- (1)Development and performance evaluation of a positive reference material for hemolysis testing.
- Haishima Y et al. J Biomed Mater Res Part B Appl Biomater. 2014 Nov. 102(8):1809-16. doi: 10.1002/jbm.b.33169
- (2)国内ラウンドロビンテストによる簡易溶血性試験法の性能評価.
- 野村ら. 日本バイオマテリアル学会シンポジウム2016. 2016. 1P-094
- (3)Proof of concept testing of a positive reference material for in vivo and in vitro skin irritation testing.
- Nomura Y et al. J Biomed Mater Res Part B Appl Biomater. 2017 Dec 11. doi: 10.1002/jbm.b.34061.
- (4)Round robin study to evaluate the reconstructed human epidermis (RhE) model as an in vitro skin irritation test for detection of irritant activity in medical device extracts.
- De Jong WH et al. Toxicol In Vitro. 2018 Jan 8. pii: S0887-2333(18)30001-8. doi:10.1016/j.tiv.2018.01.001.
- (5)Preparation of irritant polymer samples for an in vitro round robin study.
- Coleman KP et al. Toxicol In Vitro. 2018 Feb 2. pii: S0887-2333(18)30020-1. doi: 10.1016/j.tiv.2018.01.018
特定商取引法に基づく表記
| 販売事業者 | 一般財団法人食品薬品安全センター 秦野研究所 | ||
|---|---|---|---|
| 所在地 | 神奈川県秦野市落合729番地の5 | ||
| 代表者(運営統括責任者) | 小島幸一 | ||
| 連絡先 | ホームページ | https://www.fdsc.or.jp/contact/ | |
| 電子メール | rm.officefdsc.or.jp | ※マークはアイコンを表示しています。 | |
| TEL | 0463-85-2525 (内線523) | ||
| 商品等の引き渡し時期・発送方法 | 宅配便 | ||
| 代金の支払時期および方法 | 銀行振込 | ||
| 商品代金以外に必要な費用 | 送料、手数料、消費税等 | ||
| 返品の取扱条件 |
商品受け取り時に必ず商品の確認をお願いいたします。 万が一下記のような場合には返品・交換をお受けします。 ・申し込まれた商品と届いた商品が異なっていた場合。 ・商品が破損している場合。 商品到着後14日以内に上記連絡先にメールまたはお電話にてご連絡頂いた後、「送料着払い」にてご返送下さい。 |
||
